Capítulo 6
LA ADSORCIÓN DE MICROPOLUENTES ORGÁNICOS SOBRE CARBÓN ACTIVO EN EL TRATAMIENTO DEL AGUA POTABLE
Resumen
La contaminación de los cuerpos de agua por micropoluentes orgánicos, como por ejemplo los pesticidas, origina la degradación de su calidad limitando su uso como fuentes de abastecimiento de agua potable. Se requiere, por tanto, concebir tratamientos como oxidación, membranas y adsorción. Por otra parte, el agua cruda contiene un conjunto complejo de sustancias orgánicas disueltas que conforman la materia orgánica natural (MON) las cuales, al estar presente en cantidades más importantes que los pesticidas, entran en competición con éstos durante la adsorción sobre carbón activo, modificando el equilibrio entre la concentración de las fases líquida y sólida, perturbando la cinética de adsorción e influyendo sobre la eficiencia del tratamiento. La presente investigación persigue desarrollar un modelo de simulación del proceso de adsorción que considere simultáneamente los tres aspectos claves siguientes: la competencia con la MON, la cinética que controla la adsorción y la hidrodinámica del reactor utilizado. Se basa en los siguientes principios: la cinética de la adsorción obedece al Modelo de la Difusión de Superficie Homogénea, la MON puede ser modelada por un Compuesto Ficticio Único (EBC) y la competición entre el pesticida y el EBC se representa por la Teoría de la Solución Ideal Adsorbida (IAST).
Se emplearon tres tipos de pesticidas (Atrazina, Cyromacina e Imidacloprid), dos tipos de carbones activos (F-400, francés y V-100, venezolano) a 30 ºC, en agua natural y una mezcla de agua ultra-pura y agua natural (50/50). El agua natural proviene de la salida de los filtros de la Planta de Tratamiento de aguas de Barquisimeto. Los montajes experimentales incluyen un reactor discontinuo perfectamente agitado (RPA) y una columna diferencial de adsorción (DCBR). El RPA permite determinarlos parámetros de equilibrio del modelo de Freunlich (K y n) del micropoluente y del EBC, mediante las isotermas realizadas tanto en agua ultra-pura como en agua natural, utilizando el IAST. Los coeficientes de película “Kf” y de adsorción superficial “Ds” (cinética de adsorción en agua ultra-pura y natural) sobre DCBR, se obtuvieron utilizando el programa computacional de simulación ADSORPA.
Palabras Clave: Pesticidas, Carbón Activo, materia orgánica natural, modelación.
Introducción
La contaminación de las aguas por pesticidas tiene principalmente un origen agrícola. Estas sustancias son transportan por las aguas naturales, por solubilización y escorrentía, o por volatilización y dispersión aérea. Por este motivo, la calidad de las aguas crudas utilizadas para consumo humano, se ha ido degradando y ha sido necesario concebir tratamientos adicionales como: la oxidación con ozono, la filtración por membranas y la adsorción sobre carbón activo. El uso de carbón activo está reconocido como uno de los métodos más eficaces para eliminar este tipo de polución; en efecto, la eliminación de micropoluentes orgánicos por adsorción sobre carbón activo en grano o en polvo se utiliza frecuentemente en las plantas de tratamiento de agua potable, dada su alta versatilidad, el carbón activo posee buenas propiedades adsorbentes para una amplia gama de micropoluentes orgánicos. La mejor relación costo/efectividad se obtiene con el carbón activo en grano usado al final de la planta de tratamiento, antes de la etapa de desinfección. Por su costo, el carbón activo en polvo se usa sólo en caso de picos importantes de polución, agregándose al inicio del tratamiento, generalmente en la etapa de coagulación–floculación, a nivel del decantador.
Sin embargo, la instalación del tratamiento necesita de estudios previos de laboratorio y/o a escala piloto, largos y costosos. Por otra parte, el agua cruda contiene un conjunto complejo y variado de sustancias orgánicas disueltas que conforman la materia orgánica natural (MON). Estas sustancias, en cantidades mucho más importantes que los pesticidas, van a entrar en competición con éstos cuando se efectúa la adsorción, modificando el equilibrio entre las fases líquida y sólida, y perturbando la cinética de adsorción. Por tanto, los fenómenos de competición entre la adsorción de los micropoluentes y la MON influyen sobre la eficiencia del tratamiento.
Para resolver este problema, se han hecho numerosas investigaciones para elaborar modelos de simulación del proceso de adsorción, utilizando reactores perfectamente agitados o lechos granulares filtrantes, a través de experimentos simples y cortos. Sin embargo, los diferentes modelos no toman en cuenta simultáneamente los tres aspectos claves inherentes a la adsorción de un pesticida en un agua natural: la competición con la MON, la cinética que controla la adsorción y la hidrodinámica del reactor utilizado.
Proceso de adsorción
Mecanismo General de la Adsorción.
La adsorción corresponde a la transferencia de una molécula de la fase líquida hacia la fase sólida. Este fenómeno obedece a las leyes de equilibrio entre la concentración en fase líquida y la concentración en fase sólida, sobre la superficie del material adsorbente. La adsorción de un soluto se efectúa según una sucesión de cuatro etapas cinéticas:
a. Transferencias del soluto desde el seno de la fase líquida hacia la película líquida que rodea el adsorbente. Esta transferencia se hace por difusión y/o convección.
b. Transferencia del soluto a través de la película líquida hacia la superficie del adsorbente. Caracterizada por el coeficiente de transferencia de masa global externa (Kf), parámetro inversamente proporcional a la resistencia ejercida por la película externa a la transferencia de masa. El espesor de esta película externa, &delta, y Kf dependen de las turbulencias existentes en el interior de la fase líquida.
c. Difusión del soluto en el grano, bajo los efectos del gradiente de concentración. Esta difusión puede hacerse: en estado libre, en el líquido intraparticular (el coeficiente de difusión porosa, Dp, caracteriza esta migración); o en estado combinado, de un sitio de adsorción a otro adyacente (el coeficiente superficial, Ds, es especifico de esta etapa). Algunos autores (Noll,1992) no establecen una diferencia entre estos coeficientes y los agrupan en uno solo, Defc, Coeficiente de Difusión Efectiva.
d. Adsorción propiamente dicha. Este fenómeno corresponde al sistema de más baja energía y se caracteriza por las interacciones soluto–soporte, que pueden ser de dos tipos: la adsorción física (fisiosorpión) que se basa en las fuerzas intermoleculares débiles (Van der Waals o electrostática), cuyos efectos son reversibles, y la adsorción química (quimiosorción) que se basa en las fuerzas de naturaleza covalente, cuyos efectos son casi siempre irreversibles. La existencia de tales enlaces supone la presencia de sitios reactivos. Siempre intervienen simultáneamente los dos fenómenos, pero la fisiosorpción parece ser el mecanismo preponderante.
Estas etapas se efectúan en serie siendo la más lenta la que impone la cinética. Para la mayoría de los autores, las etapas 1 y 4 son rápidas; por lo tanto, es la transferencia de masa a través de la película y de difusión en el interior del grano (superficial y porosa) las que controlan la cinética de adsorción.
Factores que Influyen en la Adsorción.
La adsorción depende de la naturaleza y la estructura del adsorbente, de las propiedades físico–químicas del adsorbido y del medio en el cual la adsorción debe efectuarse. El medio puede intervenir modificando las propiedades físico–químicas del adsorbente (solubilidad, carga superficial, carácter hidrófobo/hidrófilo, etc. ), modificando la accesibilidad a los sitios de adsorción por recubrimiento de la superficie externa del adsorbente o introduciendo compuestos susceptibles de entrar en competición con la molécula cuya eliminación se busca. Es el caso de las aguas naturales, que contienen numerosas sustancias orgánicas o minerales que pueden modificar la adsorción de una molécula específica. Numerosos compuestos son susceptibles de ser adsorbidos por el carbón activo y, por lo tanto, los micropoluentes a eliminar entran en competición con esas sustancias; existe además la posibilidad de interacción soluto/MON que influye fuertemente sobre la adsorción. Por tanto, la presencia de MON influye sobre la velocidad de adsorción del micropoluente.
Modelos de Equilibrio de la Capacidad de Adsorción.
Los modelos de la capacidad de adsorción son necesarios para poder “predecir” cuando las concentraciones de la molécula específica es muy baja. En efecto, los ensayos de laboratorio se realizan generalmente con concentración elevadas de la molécula específica a fin de no complicar demasiado la dosificación (evitar la etapa de extracción líquido/sólido) y, al mismo tiempo, poder utilizar masas de carbón activo cuya pesada puede hacerse con una buena precisión.
Adsorción de solutos en solución pura.
Cuando el adsorbente está en contacto con la molécula específica adsorbida se alcanza, luego de un tiempo, un estado de equilibrio entre la solución y el material adsorbente. Este estado de equilibrio se caracteriza por una concentración residual de adsorbido “en el equilibrio”, llamada Ce, y por una cantidad del adsorbido fijado sobre el material “en el equilibrio” qe. Los valores de qe y Ce se pueden determinar experimentalmente, determinando los valores que forman parte de las isotermas.
La modelación del equilibrio de adsorción o de la capacidad de adsorción consiste en representar, por modelos matemáticos, el estado de equilibrio que determinan las concentraciones de soluto en solución y sobre el material adsorbente. Los modelos permiten conocer la cantidad máxima susceptible de ser fijada sobre el adsorbente para una concentración en disolución dada; es decir, la modelación consiste en buscar una relación teórica entre estos dos valores: Ce y qe.
El modelo de Freundlich es el más usado y posee dos constantes (K y n). Se expresa como:


El modelo reposa sobre las hipótesis de que sólo interviene la fisiosorpción y que no hay asociación de moléculas después de su adsorción. Presenta una limitación importante, pues no admite fenómenos de saturación; la capacidad qe se incrementa hasta el infinito con el aumento de Ce. Su validez, en el caso de bajas concentraciones, fue verificada por numerosos autores (Knappe, 1993; Najm, 1996); sin embargo, este modelo está limitado a la representación de la adsorción de un compuesto único en una fase inerte. No permite representar el caso de adsorción competitiva cuando la molécula específica está en presencia de otras sustancias que entran en competición durante la adsorción.
Adsorción de Soluto en Competición (IAST)
La mayoría de los autores utilizan la Teoría de la Solución Ideal Adsorbida (Ideal Adsorbed Solution Theory), propuesta por Myers y Prausnitz (1965) para la adsorción de mezclas gaseosas y aplicada a los sistemas acuosos por Radke y Prausnitz (1972). Este modelo está basado en las dos hipótesis termodinámicas siguientes: la superficie disponible es invariante y equivalente para todos los compuestos y la fase adsorbida, constituida por N compuestos, se comporta como una solución ideal.
Este modelo es actualmente de uso corriente para representar la adsorción de micropoluentes en aguas naturales (Najm, 1991; Knappe, 1993; Prados, 1994; Gicquel, 1996). La ventaja es que se necesita conocer únicamente los parámetros de adsorción de cada uno de los solutos competidores en solución pura, por lo que todas las relaciones de equilibrio (por ejemplo, Freundlich) pueden ser usadas.
Competición MON / Pesticida (EBC)
En la práctica, cuando se considera la adsorción de un soluto sobre carbón activo en agua natural, éste se encuentra en competición con la MON, la cual es una matriz heterogénea de sustancias diferentes, de tallas moleculares y afinidades diversas. En la mayoría de los casos, la composición de esta matriz orgánica es difícil de caracterizar, por ello, se han propuesto varias aproximaciones. Un método (Frick, 1983) consiste en dividir la MON en varios compuestos ficticios. El número de estos compuestos depende de la forma de la isoterma global en agua natural. Crittenden (1985) representa la materia orgánica en uno o dos compuestos ficticios. Comparando las isotermas del micropoluente en solución pura y en agua natural se obtienen los coeficientes de equilibrio de estos compuestos ficticios. Najm (1991) ha propuesto una modificación al método de Crittenden (1985), en el sentido de considerar que la MON del agua que entra en competición se puede representar por un único compuesto ficticio, denominado Equivalent Background Compound (EBC). Esta consideración permite simplificar el sistema, pues el agua natural contendrá sólo dos “sustancias” en competencia: el EBC y la molécula específica.
Una isoterma de la molécula específica en solución pura permite determinar K1 y n1, por aplicación directa de Freundlich, siendo los valores de K1 y n1 constantes cualquiera que sea la concentración inicial de la molécula o las dosis de carbón activo, Cc. Las constantes C2,0 , K2 y n2 del compuesto ficticio se pueden determinar realizando la correspondiente isoterma de la molécula específica en agua natural. Para limitar el número de soluciones para el conjunto C2,0 , K2 y n2; es posible hacer una aproximación compleja que consiste en realizar una tercera isoterma, basada en el hecho de que la competición entre la matriz orgánica y la molécula específica depende de la relación de sus concentraciones. Así, Gicquel (1996) propone, tomando en cuenta la desproporción entre las concentraciones de la matriz orgánica y de la molécula específica, cambiar la concentración de la matriz orgánica diluyendo en una mezcla 50/50 agua natural/agua ultra-pura. En conclusión, la previsión de la capacidad de adsorción en agua natural para el conjunto: molécula específica, agua natural y carbón activo, necesita la realización de tres isotermas: una isoterma en agua ultra-pura, para obtener K1 y n1; una isoterma en agua natural, concentración inicial C1,0, y una isoterma en agua natural diluida (x2) con agua ultra-pura C1,0 variable.
Modelación de la Cinética de Adsorción
La adsorción de una molécula específica depende de la capacidad de adsorción en el equilibrio del carbón activo (basado en un tiempo de contacto “infinito”) pero igualmente, de la cinética de adsorción; es decir, de la velocidad con la cual la molécula específica pasa de la fase líquida a la fase sólida. Hemos visto que el transporte de la molécula específica hacia los sitios de adsorción, implica varias etapas y diversos mecanismos de difusión externa (a través de la película líquida) e interna (poroso o superficial). Estos diferentes procesos de difusión están caracterizados por tres parámetros de difusión: Kf, Dp y Ds, respectivamente. La cinética de adsorción es entonces gobernada por las leyes de la transferencia de masa.
Modelo HSDM: Transferencia Externa Acoplada a la Difusión Superficial
Hemos visto que el efecto de la difusión porosa es mucho menor que la difusión superficial externa y superficial. Por ello, a menudo sólo se consideran los mecanismos de difusión externa y superficial. Sobre esta hipótesis reposa el Modelo de Difusión Homogénea de Superficie (Homogeneous Surface Diffusion Model) o HSDM, propuesto por Weber y Chakravorti (1974) y usado con éxito por Traeger (1989), Greene (1994), Knappe y Snoeyink (1994), para representar la cinética de adsorción de diversos compuestos orgánicos sobre carbón activo.
Este modelo se basa en:
* El balance de masa en el reactor considerado (RPA, microcolumna, lecho
fijo, etc).
* La transferencia intragranular es asegurada por la difusión superficial.
* La continuidad entre el flujo “externo” y el flujo “interno”
a nivel de la superficie del grano.
* El equilibrio entre la cantidad adsorbida y la concentración
en la superficie externa de la película.
* La esfericidad y la homogeneidad del grano de adsorbente.
Un software de cálculo basado en el método HSDM permite determinar los parámetros característicos Ds y Kf, a partir de filtración sobre minicolumnas. El valor de Kf, siendo dependiente de las condiciones de agitación, en reactor estático, es generalmente considerado como no limitante por numerosos autores (Najm, 1990; Adham, 1991).
El programa informático, propuesto por Geene (1994) y Knappe – Snoeying (1993), permite:
- Determinar los valores de Kf y Ds a partir de un experimento en reactor agitado estático. Básicamente, Kf depende de la agitación mientras que Ds es, a priori, independiente de los parámetros físicos y depende principalmente de la competición.
- “Predecir” la cinética de adsorción para una concentración inicial diferente de la molécula específica, considerando los valores de Kf y Ds como no dependientes de la concentración inicial. El modelo toma en cuenta los parámetros característicos del carbón activo usado y sobre todo las características de talla o diámetro medio.
Hipótesis
- La Materia Orgánica Natural (MON) será modelada por el principio del compuesto ficticio único o EBC (Equivalente Background Compound).
- La competición entre el micropoluente y el compuesto ficticio será representada por la Teoría de Solución Ideal Adsorbida o IAST (Ideal Adsorbed Solution Theory).
- La cinética de adsorción será analizada a través del Modelo de la Difusión de Superficie Homogénea o HSDM (Homogeneous Surface Diffusión Model).
Procedimiento experimental
A) Materiales
A.1. Carbón Activo
Los carbones activos utilizados son el F-400 y el V-100, los cuales fueron
lavados con agua ultra-pura, secados a 110 °C durante 24 h, triturados
y tamizados para obtener diferentes granulometrías.
A.2. Los Micropoluentes Orgánicos
Las soluciones de Atrazina, Cyromacina e Imidacloprid son obtenidas por
dilución de una solución madre de 10 mg/L, filtrada a través
de una membrana de 0.45 µm. La solución madre se prepara en la
oscuridad, bajo agitación magnética del soluto en el agua
ultra-pura durante 72 horas.
A.3. El Agua Natural
El agua natural empleada en los diferentes ensayos proviene de la salida
del filtro de la planta de tratamiento de agua potable de la ciudad de
Barquisimeto.
B) Método Experimental.
El protocolo experimental incluye:
· Una serie de isotermas (parámetros de equilibrio del micropoluente)
en un RPA y una cinética de adsorción sobre una DCBR (coeficiente
de difusión del micropoluente), con agua ultra-pura.
· Dos series de isotermas en el RPA: para el agua natural cruda
y diluida (parámetros de equilibrio de la EBC y concentración
inicial) y una cinética de adsorción en la DCBR (coeficiente
del EBC).
B.1. Reactor Discontinuo Perfectamente Agitado
Necesario para obtener las isotermas de adsorción
y poder determinar los parámetros de equilibrio de adsorción
sobre carbón activado en polvo (CAP) para un compuesto en agua
ultra-pura y en agua natural. El método consiste en preparar una
solución que contenga el micropoluente estudiado en agua ultra-pura
o en agua natural y repartirla en 6 fiolas de vidrio borosilicato de 2
litros. El primer frasco sirve de testigo sin carbón activo. En
las 5 fiolas restantes, se introducen cantidades crecientes de CAP. Estas
cantidades deben permitir el análisis del micropoluente luego de
la adsorción. Conviene, por tanto, asegurarse, mediante un ensayo
preliminar, que la concentración residual en el equilibrio es superior
al límite de detección del método analítico
empleado.
Luego de la introducción del CAP, los frascos son
cubiertos (con papel de aluminio), agitados magnéticamente y mantenidos
a temperatura constante (30°C) en un baño termostatizado. Luego
de varios días de agitación hasta alcanzar el equilibrio,
se toman muestras de cada frasco, se filtran a través de un filtro
Millipore (0.45 µm) y el micropoluente es cuantificado por el método
apropiado. La concentración del micropoluente determinada en el
frasco testigo es considerada como la inicial. Los resultados obtenidos
permiten calcular los coeficientes de Freundlich a través de una
regresión lineal.
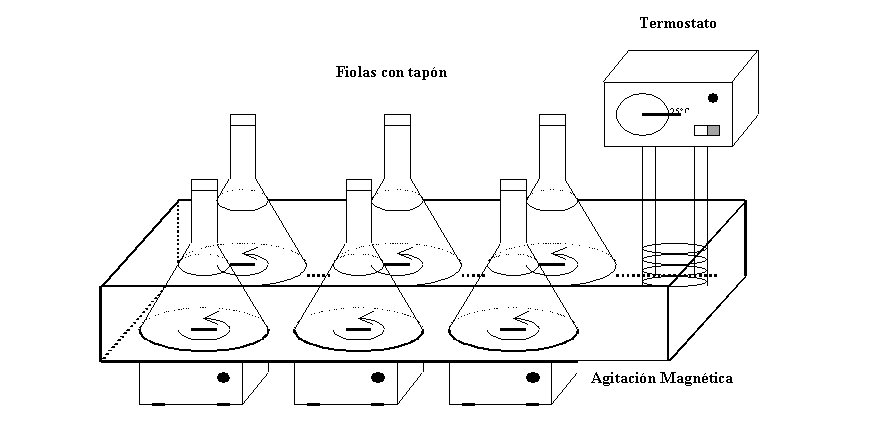
Figura 1. Montaje experimental para efectuar las isotermas de adsorción.
B.2. Columna Diferencial de Adsorción
En el método anterior, la concentración de pesticida evoluciona constantemente hasta alcanzar el equilibrio. En dinámica, el carbón activo en el reactor se satura progresivamente hasta que alcance su capacidad máxima de adsorción. El ensayo finaliza cuando la concentración de la molécula estudiada alcanza un valor máximo adsorbido, por lo que su concentración no varía con el tiempo manteniéndose constante.
El coeficiente de difusión del pesticida es determinado a partir de cinéticas de adsorción en agua ultra-pura y el correspondiente al EBC, a partir de cinéticas de adsorción usando agua natural.
A fin de satisfacer las condiciones de la ecuación del balance de masas y aproximarse lo más posible al concepto de RPA, se utilizará la técnica de la columna diferencial de adsorción (DCBR) pues permite, con una agitación eficiente a nivel del depósito (5 litros) y un caudal suficiente (100 L/h), minimizar la influencia del coeficiente de transferencia de masa externa (Kf).
El esquema del montaje, menos clásico que el de las isotermas,
es el siguiente:
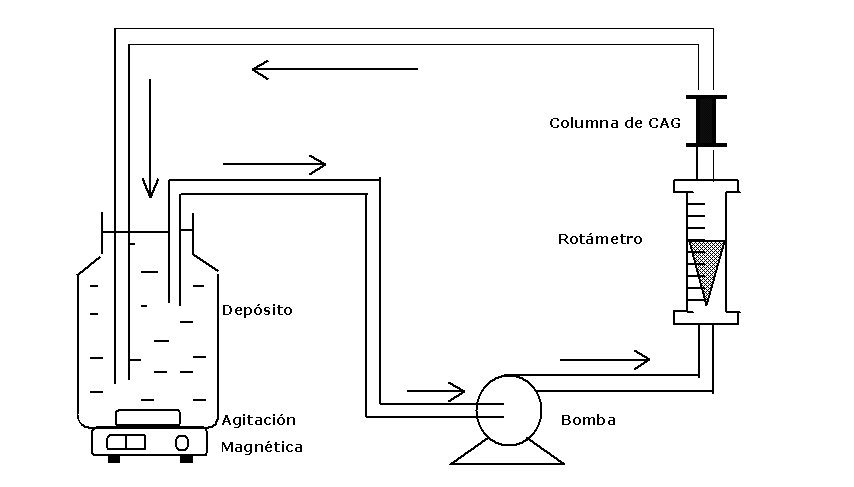
Figura 2. Montaje experimental de la columna diferencial de adsorción (DCBR).
El experimento se realiza con una solución de 5 litros de pesticida a concentraciones que varían entre 100 y 600 μg/L y sobre una masa de carbón activo durante 3 a 7 días (en la oscuridad). El depósito es cerrado para limitar los fenómenos de evaporación.
Las muestras (5 mL) son regularmente tomadas en el seno del depósito, filtradas sobre el filtro de Millipore (0.45 µm) y analizadas a fin de determinar la concentración residual de pesticida.
Adicionalmente se toman 10 mL para el análisis de COT.
La capacidad de adsorción puede entonces ser determinada para unas condiciones precisas: una concentración de micropoluente, un tiempo de residencia hidráulica, una temperatura y una calidad de agua determinados.
Resultados y Discusión
Los pesticidas fueron analizados mediante un equipo de
Cromatografía Líquida de Alta Presión (HPLC) y la
materia orgánica natural inicial contenida en el agua natural,
a través de la medida de Carbono Orgánico Total (COT).
· Etapa 1. Esta etapa experimental comprendió
la realización de las isotermas en agua ultra-pura, utilizando
los tres pesticidas y los dos carbones activos, para una temperatura constante
de 30ºC. Obteniéndose las constantes de la ecuación
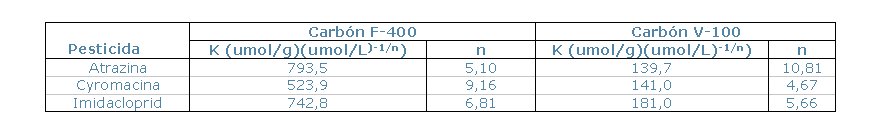
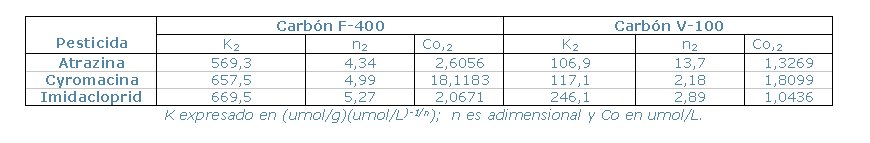
de Freundlich (K y n), mostradas en la Tabla 1.
Tabla 1. Constantes de Freundlich.
· Etapa 2. De tipo experimental,
comprende la realización de las cinéticas sobre Columna
Diferencia de Adsorción (DBCR) en agua ultra-pura, de los tres
pesticidas y los dos carbones activos, a temperatura constante de 30 ºC.
· Etapa 3. Consiste en la realización de
la simulación de la cinética de adsorción, en agua
ultra-pura de cada pesticida y los dos carbones activos. Se utiliza el
programa ADSORPA y los valores simulados se comparan con los experimentales
de la etapa 2.
Los resultados experimentales y las simulaciones utilizando el programa
ADSORPA se representan en los gráficos que se muestran a continuación.
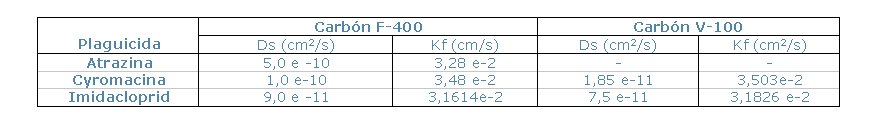
Los resultados del programa utilizado para determinar el coeficientes
de difusión superficial “Ds”se muestra en la Tabla
2.
Tabla 2. Coeficientes de Difusión Molecular (Ds) y de Película (Kf).
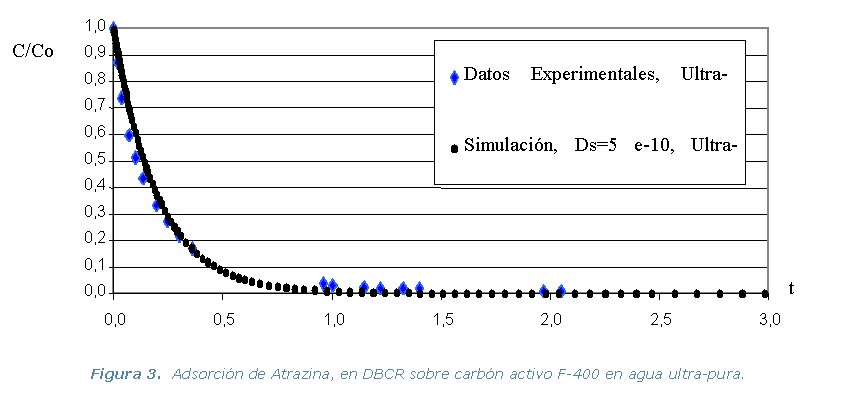
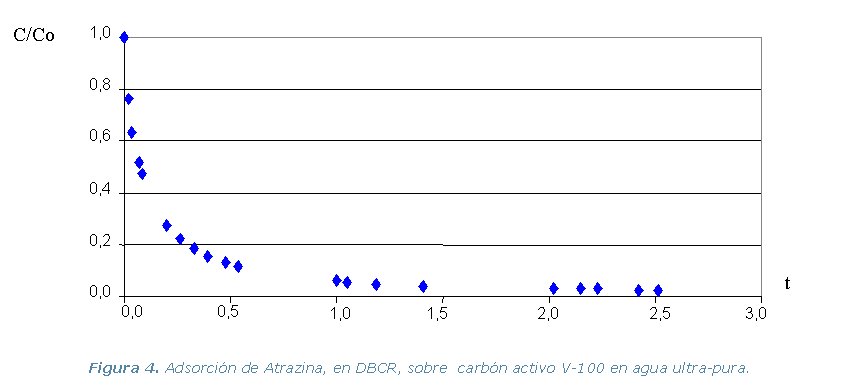
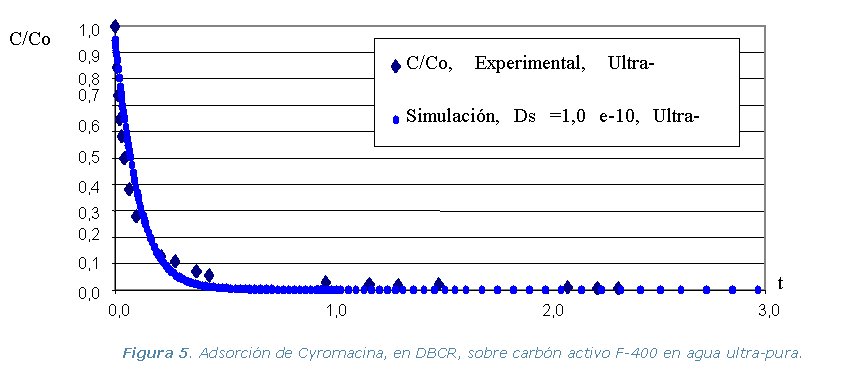
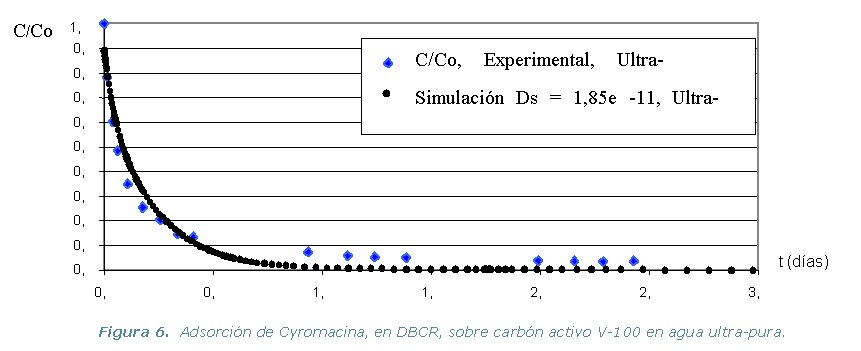
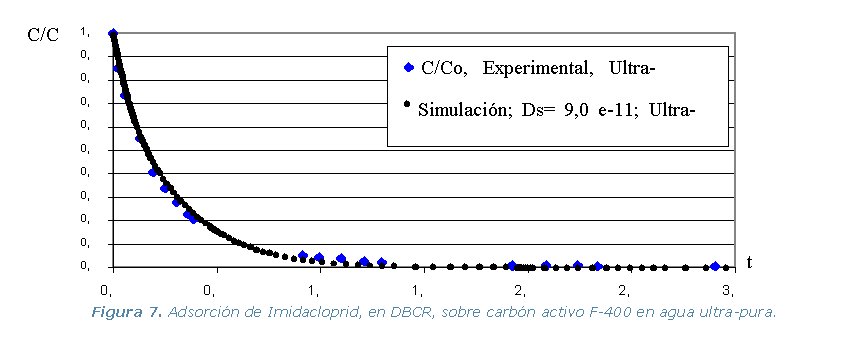
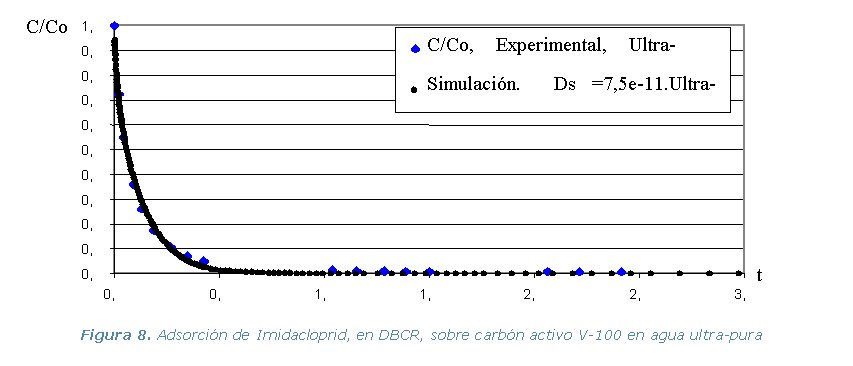
· Etapa 4. Experimental. Comprende la realización
de las isotermas en agua natural y una mezcla de agua ultra-pura y agua
natural (50/50), utilizando los tres pesticidas y los dos carbones activos,
temperatura constante de 30 ºC.
· Etapa 5. Informática. Tiene como objetivo
la obtención de los parámetros de competición de
los pesticidas con la materia orgánica del agua natural, utilizando
el programa IAST. En la Tabla 3, se presentan los resultados obtenidos
por el programa IAST, que estudia la competición en la adsorción
de los pesticidas con el EBC (Compuesto equivalente o materia orgánica
presente en el agua natural). Los resultados de los equilibrios isotérmicos
de adsorción a 30 ºC, se representan en los gráficos
que se muestran a continuación.
Tabla 3. Parámetros de Equilibrio del EBC (K, n y Co).
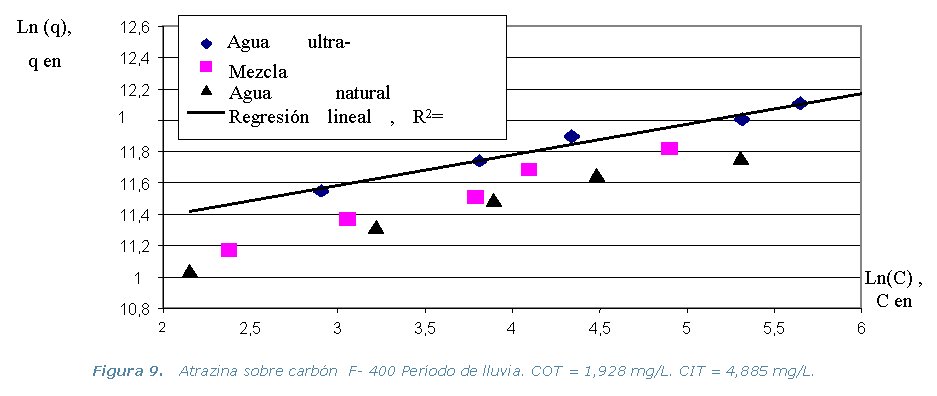
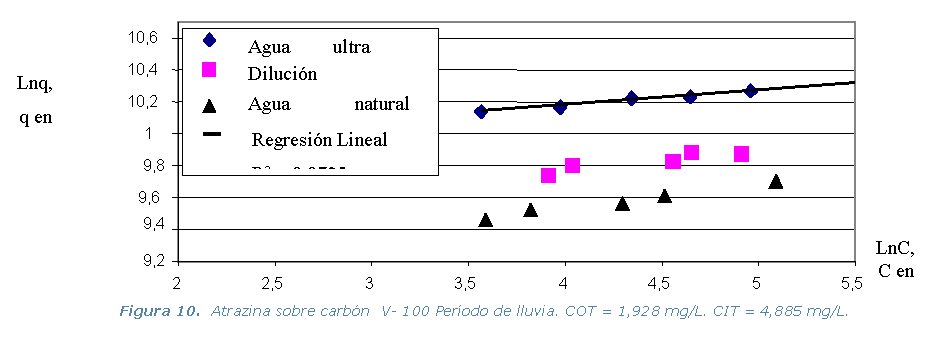
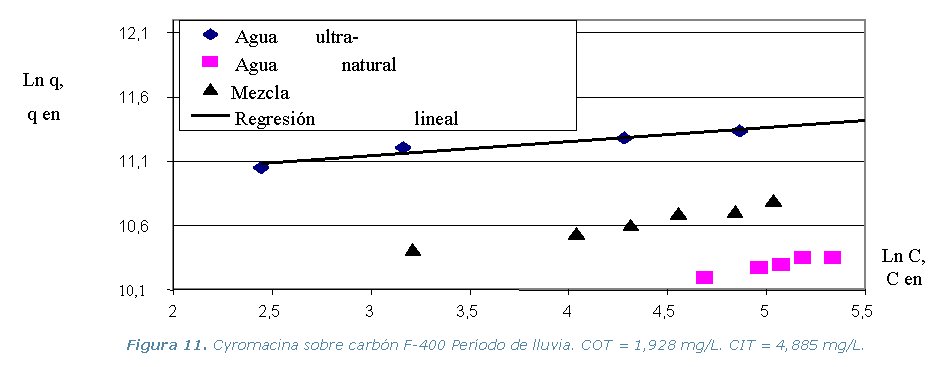
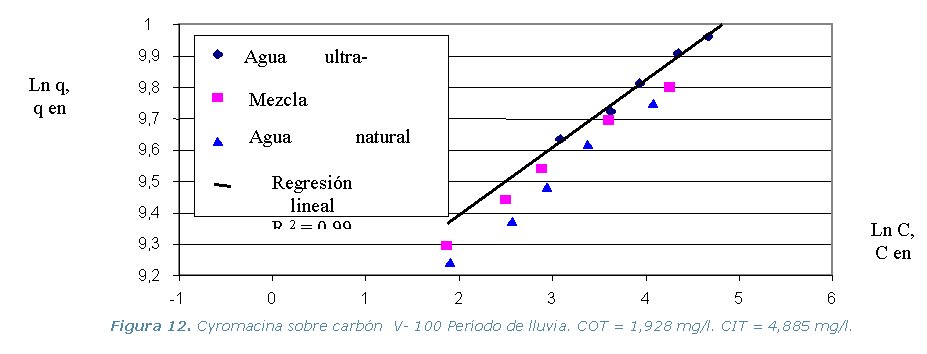
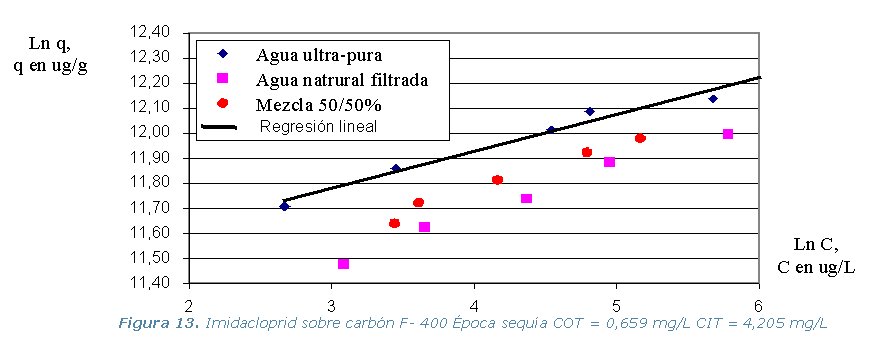
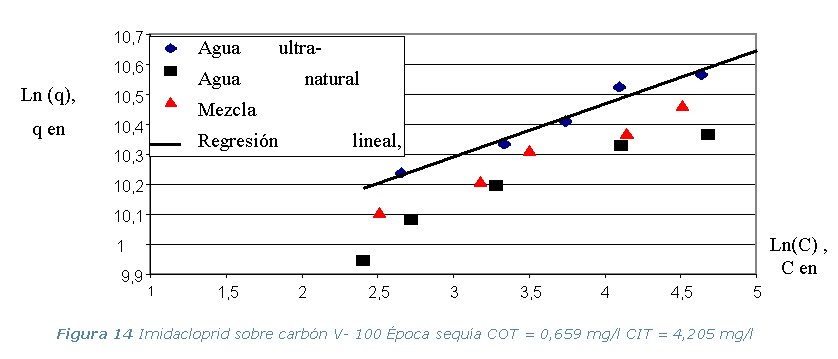
· Etapa 6. Cinéticas sobre Columna Diferencial de Adsorción (DBCR).
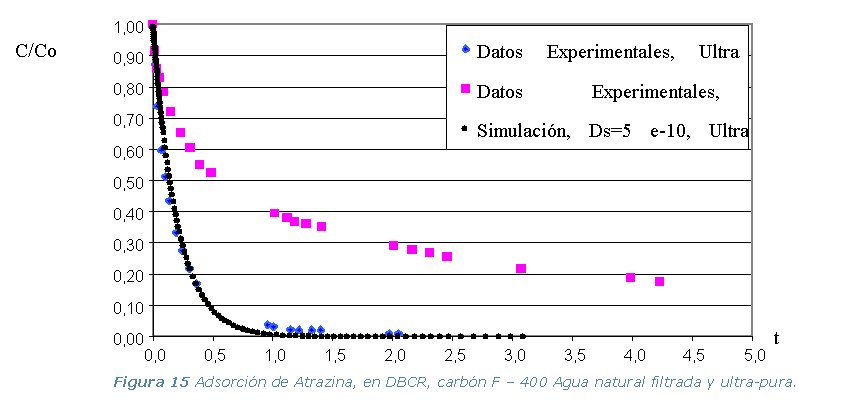
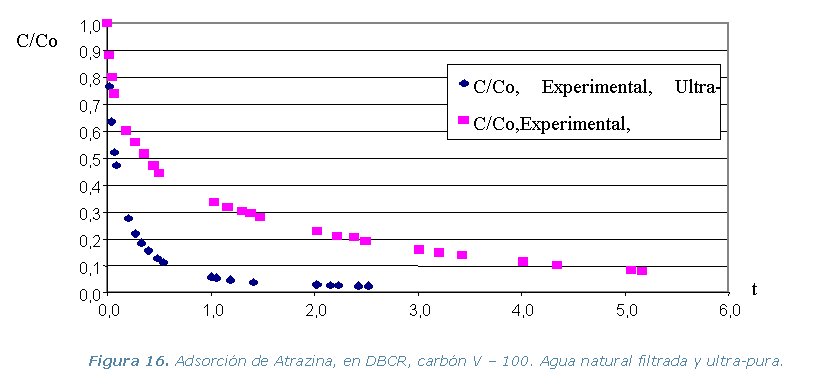
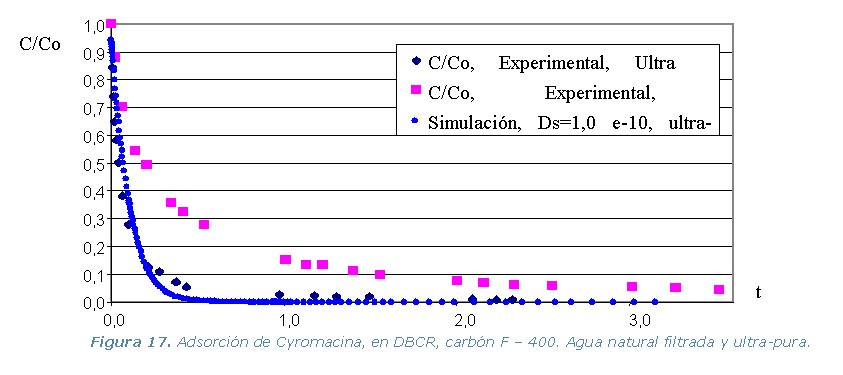
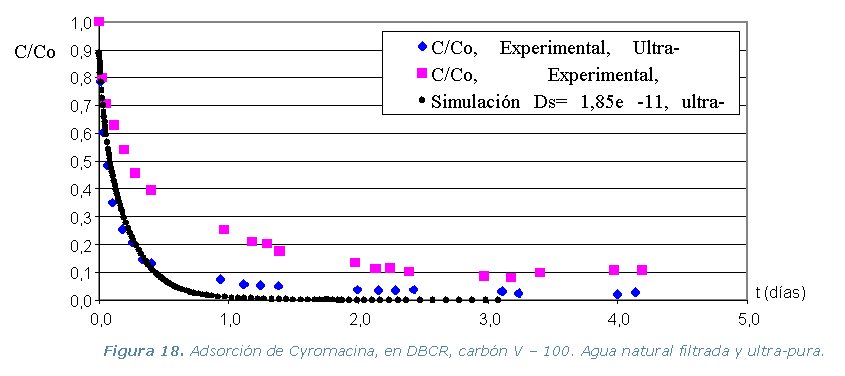
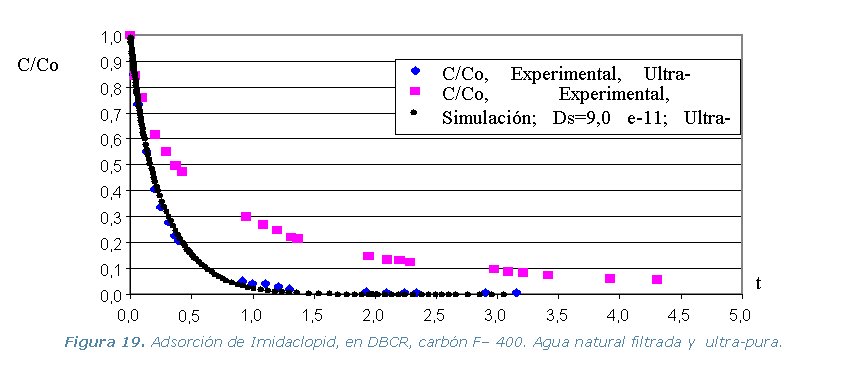
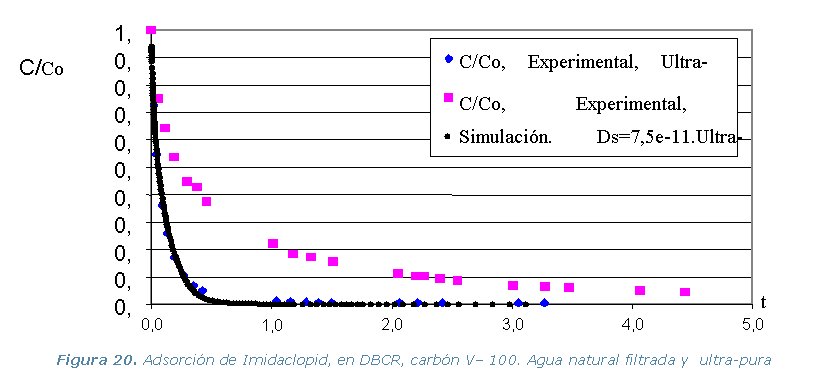
Conclusiones
En el presente trabajo de investigación, se instrumentó
un protocolo experimental que permite, mediante manipulaciones simples
y rápidas, simular correctamente la cinética de adsorción
de los pesticidas sobre carbón activo en agua natural. Dicho protocolo
experimental, menos costoso que un estudio piloto sobre un lecho filtrante,
requiere solamente: Una serie de isotermas del soluto en agua ultra-pura
(parámetros de equilibrio del soluto), una cinética de adsorción
del soluto en agua ultra-pura (coeficiente de difusión del soluto),
dos series de isotermas del soluto en agua natural (parámetros
de equilibrio de la MON y su concentración inicial) y una cinética
de adsorción del soluto en agua natural (coeficiente de difusión
de la MON).
El carbón venezolano (V- 100) tiene una capacidad de adsorción muy inferior al carbón francés (F – 400), debido a que posee una menor área superficial por lo que se satura más rápidamente.
El peso molecular (tamaño de la molécula) del pesticida influye directamente sobre el tiempo en que se alcanza el equilibrio. Siendo por tanto interesante el poder construir bases de datos de los parámetros de equilibrio y los coeficiente de difusión superficial en agua ultra-pura de cada pesticida. Quedando por hacer, en caso de una aplicación, las manipulaciones para cada tipo de agua natural.
Agradecimientos. Al Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT) de la Universidad Centroccidental Lisandro Alvarado y al Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT) por el financiamiento del presente proyecto de investigación.
Bibliografía
JIAN – YING, H ET COLL. “Adsorptive Characteristics
of aromatic pesticides in water on powdered activated carbon”. Wat.
Res, Vol 32 N° 9, pp 2593 – 2600, 1998.
JULIE, F; BAUDU, M; MAZET M. “Relation ship between chemical and
physical surface properties of activated carbon”. Wat. Res. Vol
32 N° 11 pp 3414 – 3424, 1998.
LEBEAN, T; LELIEVRE, C; WOLBERT, D; LAPLANCHE, A; PRADO, M Y COTE P. “Effect
of natural organic matter loading on the atrazine adsorption capacity
of an again powdered activated carbon slurry”. Wat. Res, Vol 33
N° 7, pp 1695 –1705, 1999.
NEWCOMBE, G; DRIKAS, M; HAYES, R. “Influence of characterised natural
organic material on activated carbon adsorption: II Effect on pore volume
distribution and adsorption of 2 methylisoborneol” Wat. Res. Vol
31, N° 5. pp 1065 – 1073, 1997.
PELEKANI, C; SNOEGINK V. L. “Competitive adsorption in natural water:
Role of activated carbon pore size”. Wat. Res. Vol 33, N° 5,
pp 1219 – 1219, 1999.
SMITH, E. “Bench – Scale test and modelling of adsorption
of natural organic matter by activated carbon”. Wat. Res. Vol 28,
Nº 8, pp 1693 –1702, 1999.
SMITH, E. “Evaluation of multicomponent adsorption equilibrium for
organic mixtures on to activated carbon”. Wat. Res. Vol 25 N°
2, pp 125 – 134, 1991.