Capítulo 14
CONSIDERACIONES SOBRE LOS SUBPRODUCTOS DE LA DESINFECCIÓN
Resumen
La desinfección con cloro de los suministros de agua pública es reconocida como uno de los mayores logros en el campo de salud pública del siglo XX, eliminando virtualmente enfermedades abundantes tales como cólera, tifoidea y disentería. Sin embargo se expresa constantemente una preocupación sobre los efectos potencialmente adversos de los subproductos de la desinfección (SPD), es decir trihalometanos (THMs), ácidos haloacéticos (HAAs), etc., que están presentes en el agua. A continuación se presenta una discusión de los beneficios de la desinfección principalmente con cloro de los suministros de agua potable, y los riesgos potenciales asociados con la formación de subproductos de la desinfección.
Palabras claves: Desinfección, cloro, trihalometanos, riesgo.
De acuerdo con los Centros para el Control y Prevención de Enfermedades (CDC) de los EE,UU., la desinfección con cloro del agua para consumo humano es reconocida como uno de los mayores logros en el campo de la salud pública del siglo XX (CDC, 1999). Sin embargo surge una preocupación para la salud pública: la presencia de SPD debido a la desinfección con cloro del agua potable debido a una posible conexión carcinogénica. Por esta razón, se ha producido un ajuste progresivo en las normas de calidad para el agua potable en lo que respecta a la concentración máxima aceptable (CMA) de TTHM.
Enfermedades propagadas por el agua
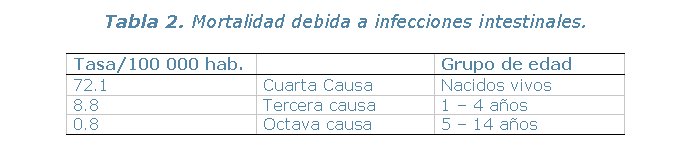
Cada año, casi 1,500 millones de personas padecen de enfermedades evitables propagadas por el agua, tales como cólera, fiebre tifoidea, disentería, giardiasis, esquitosomiasis y hepatitis A. La Organización Mundial de la Salud (OMS) calcula que más de nueve millones de personas mueren cada año a través del mundo a causa de agua contaminada (Tabla 1). Eso equivale a 25,000 personas por día, muchas de las cuales son niños menores de cinco años de edad (Tabla 2). Las Naciones Unidas proyectan que para el año 2025, más de dos tercios de la población global vivirá en países con serios problemas de carencia de suministros de agua limpia.
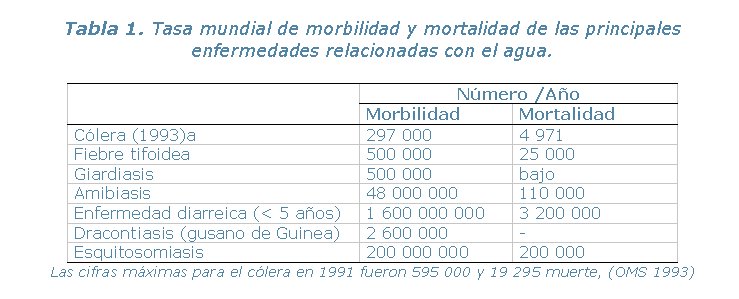
Los aumentos de población -y sus impactos relacionados- continúan ejerciendo una gran presión sobre los recursos de agua alrededor del mundo. Al mismo tiempo, el aumento de residuos municipales y agrícolas, aguas de desagüe y productos derivados de la industria, además de los efectos climáticos globales y desequilibrios ecológicos comprometen aún más la calidad del agua.
Desinfección del agua potable
Los desinfectantes más comúnmente usados son: cloro gas (Cl2), hipoclorito de sódio (NaOCl, 12.5% de cloro disponible), hipoclorito de calcio (Ca(OCl)2, 70% de cloro disponible), cloraminas, dióxido de cloro (ClO2) y ozono (O3). Otros desinfectantes como rayos ultravioleta, bromo, yodo y plata no se han empleado en forma generalizada. Cada uno de los desinfectantes que se emplean tiene sus ventajas e inconvenientes en función de su costo, eficacia, estabilidad, facilidad con que se aplique, y formación de subproductos de la desinfección.
Consideraciones de la cloración y los subproductos de la desinfección (SPD)
A principios de los años 1900, se inició la cloración de los suministros de agua potable en las naciones desarrolladas, seguida por una reducción drástica en las epidemias de enfermedades bacterianas, eliminando virtualmente la tifoidea y el cólera. Sin embargo, en los países en vías de desarrollo, estas enfermedades propagadas a través del agua siguen presentándose.
Además de proveer protección contra los patógenos virales y bacterianos, los desinfectantes con base de cloro también mejoran la estética del agua, que puede ser deteriorada por las algas y la vegetación podrida (color, sabor y olor). La Organización Mundial de la Salud (OMS) ha informado que el sabor promedio y la concentración de umbrales de olor del cloro residual aumenta de 0.075 ppm a 0.450 ppm cuando el pH aumenta de 5.0 a 9.0. A pH 7.0 el umbral promedio fue de 0.156 ppm con un intervalo de variación de 0.02-0.29 ppm; sin embargo, cuando el cloro se combina con sustancias fenólicas y con otros compuestos orgánicos, el sabor desagradable y los olores pueden exacerbarse considerablemente. El cloro ayuda a controlar que la bacteria vuelva a crecer, proporcionando un nivel residual de desinfectante en el sistema de distribución. En muchas áreas, tanto en los países desarrollados como de los países en vías de desarrollo, estos sistemas de largas tuberías no han sido reemplazados o vueltos a revestir, lo cual hace que frecuentemente tengan óxido, escamas, presenten formación de biopelículas, fugas y grietas –al igual que vaciado intencional con sifón- los cuales pueden llevar a eventos de recontaminación que comprometen la calidad del agua. Esta es la razón por la que es importante contar con cierto nivel de desinfectante residual.
A pesar de que el cloro presenta muchos beneficios para la salud pública y el tratamiento del agua, estudios recientes indican que también puede existir una relación causal entre la desinfección del agua con cloro y la salud reproductora o fetal. Otros estudios han indicado que el consumo de agua tratada con cloro puede traer consigo efectos negativos a largo plazo, como el cáncer.
Reacciones en medio acuoso
Cuando se añade cloro al agua en forma de Cl2 se producen dos reacciones: la reacción de hidrólisis y la de disociación.
La de hidrólisis se puede definir de la siguiente manera:
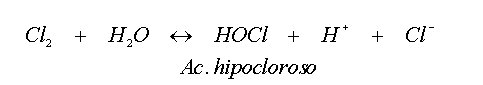
La magnitud de la constante de hidrólisis de equilibrio es tal,
que la hidrólisis a ácido hipocloroso (HOCl) prácticamente
se completa en el agua dulce a pH>4 y con dosis de cloro de hasta 100
mg/L. El HOCl es un ácido débil que se disocia parcialmente
en el agua del siguiente modo:
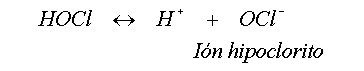
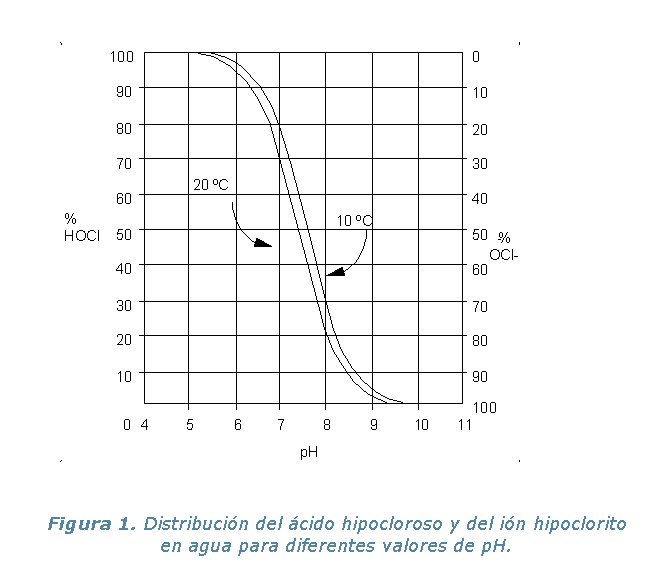
El valor de la constante de ionización ácida es aproximadamente de 3·10-8. Como se muestra en la Figura 1 a 20 ºC y pH 7.5, hay una distribución igual de HOCl y el ión hipoclorito (OCl-). A pH 8, cerca del 20% del cloro residual libre está presente como HOCl; y a pH 6.5 el 90% como HOCl. El término “cloro residual libre” se refiere a la suma de HOCl y de OCl-. Ya que el HOCl es un desinfectante considerablemente más eficaz que el OCl- y que el cloro libre, incluso como hipoclorito, es más eficaz que el cloro combinado (por ejemplo las cloraminas). Se recomienda que la desinfección final produzca una concentración residual de cloro libre de ³ 0.5 mg/L después de 30 minutos de contacto en agua a pH de <8.0. El término “cloro residual combinado” se refiere al cloro ligado al nitrógeno, presente en la formación de cloraminas.
Reacciones con el amoníaco
Las cloraminas se forman por la reacción del cloro y el amoníaco o las aminas orgánicas. Se pueden formar mono, di y tricloraminas según la relación del cloro con el amoníaco, el pH y la temperatura del agua. Las reacciones sucesivas son:
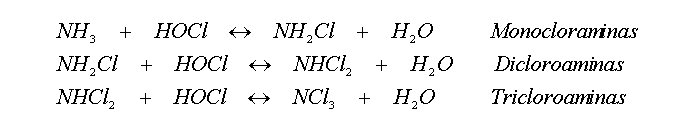
Cuando la razón molar del cloro al amoníaco no es más de 1.0 y el pH está por encima de 6, predomina la formación de monocloramina; la dicloramina predomina a pH 5 y menos, y a mayores razones de cloro-amoníaco. En el tratamiento del agua, la concentración de cloraminas es generalmente de 0.5 a 2.0 mg/L. La dicloramina y especialmente la tricloramina son compuestos olorosos y en, consecuencia, no es deseable su formación en el tratamiento del agua potable.
Reacción en el punto de quiebre
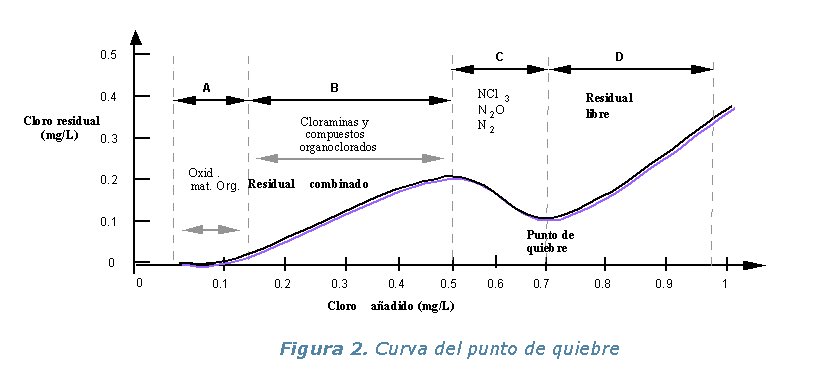
En las aguas naturales el cloro reacciona fácilmente con varias sustancias dando lugar a un consumo del cloro residual libre (A) (Figura 2). Esta reducción del cloro libre se conoce como “demanda de cloro”. La mayoría de las aguas naturales contienen materia orgánica, amoníaco u otras que ejercen esta demanda. Algunos productos de estas reacciones, como el cloruro férrico, no tienen propiedades desinfectantes, mientras que otros como las cloraminas sí las tienen, teniéndose como cloro residual combinado (B). Cuando se añade cloro más allá del punto donde sólo están presentes los residuos combinados, se encontrarán presentes tanto como cloro libre, como cloro combinado.
La representación gráfica de la variación de la concentración y del tipo de cloro residual (libre y combinado) cuando reacciona con amoníaco o material orgánico u otros compuestos, se conoce como la “curva del punto de quiebre”. Esta curva normalmente tiene una cresta y un punto de retorno (C). La parte superior de la cresta indica el punto donde los residuales combinados comienzan a cambiar de las monocloraminas a las dicloroaminas, y el punto de retorno o el “punto de quiebre” indica donde el cloro libre y posiblemente los THMs comienzan a aparecer en el residual. La adición de cloro más allá del punto de quiebre (D), producirá un aumento del cloro residual libre disponible directamente proporcional al cloro añadido.
El punto de quiebre también denota el nivel del cloro residual combinado irreducible o los “residuales molestosos” (NH2Cl, NCl3, R-NCl) que son de importancia desde el punto de vista de los sabores, los olores, y posiblemente de la salud, pero además consumen cloro. Esta curva es una herramienta valiosa para predecir cuánto cloro se requerirá para la desinfección en un periodo específico, así como para prever qué subproductos pueden formarse.
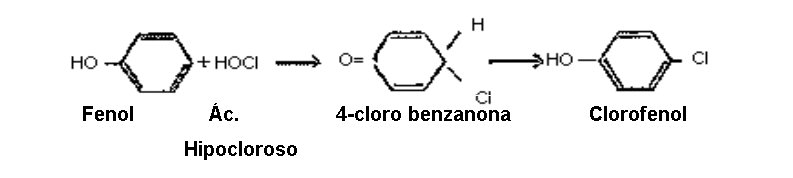
Por otra parte, se ha sabido que algunos de los peores causantes de sabor y olor son los compuestos producidos por reacción del cloro con sustancias fenólicas. Estos compuestos generalmente están presentes en los desechos industriales. La adición de pequeñas cantidades de cloro al agua que contenga esas sustancias produce compuestos clorofenólicos que dan los característicos y sumamente objetables sabores y olores fenólicos, demostraron que ha medida que aumenta el contenido de cloro, los sabores y olores también aumentan hasta un punto máximo y luego disminuyen hasta desaparecer totalmente cuando se agrega suficiente cloro y el tiempo de contacto es adecuado para que las reacciones se completen. La intensidad de los olores variaba con el tipo de compuestos. Estas reacciones, al igual que otras reacciones químicas, dependen de la concentración, el tiempo, la temperatura y el pH.
Entre todos los desinfectantes, la química y la toxicidad de los subproductos de la desinfección química (SPD) del cloro han sido los más ampliamente estudiadas. Los spd del cloro más comúnmente encontrados se pueden dividir en seis grupos: los trihalometanos, los ácidos acéticos halogenados, los acetonitrilos halogenados, los aldehídos halogenados (formaldehído), las cetonas halogenadas (cloroacetonas) y los fenoles clorados. También se encuentran entre otros: el hidrato de cloral, la furanona clorada, la cloropicrina, y el cloruro de cianógeno. Los SPD halogenados que están identificados representan solo una parte de los efectivamente formados.
Subproductos de la desinfección
Los SPD relacionados con el cloro se pueden separar en seis grupos: los trihalometanos, acetonitrilos halogenados, aldehídos halogenados, cetonas halogenadas y los fenoles clorados.
Trihalometanos
A mediados de los años 70’s varios Químicos reportaron la presencia de cloroformo y de otros trihalometanos en agua potable. Inicialmente se sugirió que era contaminación industrial o impurezas del cloro gas, lo que originó la suspensión de éste, sin embargo posteriormente grupos de colaboradores demostraron que las fuentes de estos compuestos se originaban por la materia orgánica en el agua.
Los trihalometanos constituyen un grupo de compuestos orgánicos, que como su nombre lo indica, se considera por su nomenclatura como derivados del metano (CH4), en cuya molécula, tres átomos de hidrógeno han sido sustituidos por igual número de halógenos (cloro, flúor, bromo o yodo).
En relación con la contaminación del agua potable, el problema hasta el momento se ha ceñido a la presencia de cuatro miembros del grupo que son: Cloroformo (CHCl3), bromodiclorometano (CHBrCl2), dibromoclorometano (CHBr2Cl) y bromoformo (CHBr3) el cual se asocia estrechamente con la ozonación. En vista que los cuatro SPDs anotados anteriormente se producen conjuntamente, con frecuencia se consideran como un grupo, denominado trihalometanos totales (THMsT).
De todos ellos, el que comúnmente se encuentra, es el cloroformo, razón por la que la información disponible, se refiere en forma exclusiva a ésta sustancia.
Formación de trihalometanos
La formación de los trihalometanos, durante la desinfección del agua con el cloro libre, obedece a un complicado mecanismo, por el cual las especies químicas que el halógeno forma con el agua, reaccionan con los derivados del humus que ese medio habitualmente contiene.
El fenómeno de la formación de trihalometanos se puede representar a través de la siguiente “reacción halomorfo”:
Y una hidrólisis posterior:
Existen cuatro definiciones básicas para THMs:
THMs instantáneos: Es la concentración al
momento de muestrear.
THMs final: Es la concentración final a la mayor distancia de la
distribución principal.
Formación potencial de THMs: Es determinada por la diferencia de
la concentración instantánea de THMs y de la THMs terminal.
Potencia máxima total de THMs: Este valor representa el nivel de
la concentración máximo de THMs bajo las condiciones más
favorables para la formación de THMs.
Factores que influyen en la formación y concentración de trihalometanos
- La rapidez de formación de THMs y la concentración final de THMs depende de 6 factores:
- Temperatura: Manteniendo el pH y la dosis de cloro, al aumentar la temperatura mayor es la posibilidad de formación de cloroformo.
- Efecto del pH: La formación de trihalometanos es mayor al aumentar el valor del pH del agua, por la acción catalítica del haloformo.
- Cloro residual: La concentración de cloroformo aumenta en forma directa con el residual del cloro.
- Precursores orgánicos o sustancias húmicas: Cuando en el agua existe gran cantidad de derivados del humus mayor será la posibilidad de formación de trihalometanos.
- Concentración de bromo (Br) en agua: El bromo es un constituyente natural del agua, reacciona con el cloro para formar ácido hipobromoso y a su vez éste con precursores orgánicos
- Tiempo de contacto del cloro.
Finalmente conviene señalar que los trihalometanos no se forman exclusivamente durante la fase del tratamiento del agua. Por depender de la concentración de los precursores y de la dosis de cloro residual, la reacción que da origen a los THMs, puede continuar desarrollándose en el sistema de distribución del agua potable.
Ácidos acéticos halogenados
Los ácidos acéticos halogenados se forman a partir de la materia orgánica durante la cloración del agua. Aunque no se han investigado tan a fondo como los THM, son probablemente los principales subproductos de la cloración del agua. Los ácidos mono, di y tricloroacéticos, así como los ácidos mono y dibromoacéticos, se han medido en agua potable. Si disminuye el pH, la concentración de ácidos acéticos trihalogenados tiende a aumentar y la de ácidos acéticos dihalogenados permanece constante. Los niveles típicos de los ácidos acéticos clorados en los suministros de agua potable varían de 0.03 a 0.15 mg/L.
Acetonitrilos halogenados
Se han identificado sólo como subproductos de la
cloración de aguas superficiales y subterráneas. Los precursores
potenciales para la formación de estos compuestos durante la cloración
son las algas, las sustancias húmicas y material proteínico:
los cuales estan presentes de forma natural en el agua. El más
abundante de los acetonitrilos es el dicloroacetonitrilo. En varios estudios
se encontró este compuesto en los suministros de agua muy clorada,
a concentraciones hasta de 0.02 mg/L.
Hidrato de cloral (tricloroacetaldehído)
El hidrato de cloral se forma como subproducto de la reacción del cloro con sustancias húmicas. También se puede producir en el agua a partir de descargas industriales.
Clorofenoles
Están presentes en el agua como subproductos de la reacción del cloro con compuestos fenólicos, tales como los biocidas, o como productos de la degradación de herbicidas del grupo fenoxi.
Los tres clorofenoles más probables que pueden resultar de la cloración son 2-clorofenol, 2,4-diclorofenol y 2,4,6-triclorofenol. Los umbrales gustativos son respectivamente 0.3 y 2 µg/L. Las concentraciones de los clorofenoles en el agua potable son generalmente menos de 1 µg/L.
Subproductos de la ozonación
La oxidación total de los materiales orgánicos disueltos hasta convertirlos en dióxido de carbono y agua en una solución acuosa por cualquier oxidante es rara. El ozono reacciona con material orgánico natural en el agua y forma subproductos que incluyen formaldehído, acetaldehído, glyoxal, methol glyoxal, ácidos pirúvico, oxálico, succínico, fórmico, acético y peróxido de hidrógeno. Entre estos los aldehídos son probablemente los de inquietud mayor para la salud, pero la información aún es insuficiente para evaluar los riesgos de la exposición a los aldehídos en el agua potable.
El ozono sólo no puede producir SPD halogenados directamente. Sin embargo, los iones de bromuro y yoduro se oxidan fácilmente por el ozono y el cloro dando los halógenos libres que pueden reaccionar para producir trihalometanos, en presencia de algunos compuestos orgánicos adecuados. Entonces la ozonación de aguas que contienen bromuro, mediante la oxidación de Br- a HOBr que reacciona con precursores de los SPD puede dar lugar a la producción de bromoformos, ácidos acéticos brominados, a la bromopicrina y a los acetonitrilos brominados. Además, el ozono puede oxidar los bromuros para producir bromatos.
Los materiales húmicos son resistentes a la ozonación, requiriendo largas exposiciones al ozono para producir cantidades pequeñas de ácidos acéticos, oxálicos, fórmicos y terephatalicos, CO2 y compuestos fenólicos. En un estudio, la ozonación de materiales húmicos en el agua, seguida de una cloración inmediata (dentro de 8 minutos) redujo la formación de THMs en un 65%. Sin embargo cuando las aguas ozonadas que contenían sustancias húmicas se dejaron en reposo por 24 horas después de la ozonación y luego se cloraron, no se registró reducción en las cantidades de THMs formados por cloración en sí mismos. Esto indica que aunque el ozono cambia la naturaleza química de los precursores de los THMs, hay reacciones que continúan sin la presencia de un residual de ozono y que forman sustancias igualmente capaces de producir THMs al aplicarse el cloro. Esto implica que debe considerarse el uso de tratamientos alternativos para extraer los materiales orgánicos, antes de aplicar el desinfectante residual. Dependiendo del contaminante orgánico es posible que se gana poco simplemente cambiando el desinfectante primario.
La oxidación de fenoles con ozono produce compuestos aromáticos oxidados intermedios, que experimentan la ruptura de los anillos al ser tratados con más oxidante o con un tiempo de reacción más largo. La ozonación hasta el punto de la destrucción del fenol requiere de 2 a 3 mg de ozono por miligramo de fenol.
No hay pruebas de que el ozono reacciona con hidrocarburos alifáticos saturados bajo las condiciones de tratamiento de agua. Los alcoholes alifáticos secundarios con la ozonación producen cetonas, ácidos, más peróxido de hidrógeno (H2O2). La ozonación de los compuestos aromáticos clorados rompe los anillos y parte los enlaces de carbono-cloro, formando ión cloruro, productos de oxidación alifáticos noclorados y CO2.
Los compuestos de epóxido se han aislado de las reacciones del ozono con compuestos que contienen enlaces dobles con el cloro. El heptacloro epóxido es estable a la ozonación, indicando que se puede formar con la ozonación del heptacloro. La ozonación de los plaguicidas paratión y malatión, a los niveles comúnmente usados en los procesos de tratamiento de agua, puede oxidar estos compuestos a través de los compuestos intermedios del oxón, el paraoxón y malaoxón respectivamente que son más tóxicos que los compuestos originales. Esto podría ser de importancia para los abastecimientos de agua con fuentes superficiales que están contaminadas con estos plaguicidas.
Los materiales orgánicos ozonados son en general más biodegradables que los compuestos iniciales, no oxidados. Si la ozonación se emplea como la etapa final del tratamiento en aguas que contienen sustancias orgánicas disueltas, es posible el recrudecimiento bacteriano en los sistemas de distribución. A menudo se recomienda que la ozonación esté seguida de carbono activado o de adsorción por una capa biológica para impedir este acontecimiento.
El bromato es un subproducto asociado principalmente con la ozonación o con la cloración. Hay evidencia inadecuada de la carcinogenicidad del bromoformo y clorodibromometano en los seres humanos y evidencia limitada en animales experimentales, pero el bromodiclorometano es posible carcinogénico para los seres humanos (IARC, 1991). La OMS ha establecido un valor guía provisional de 25 µg/L para el bromato, principalmente en vista de la conversión de los bromuros por el ozono. La OMS también ha establecido un valor guía de 100 µg/L para el bromoformo, que es un trihalometano que se forma fácilmente como resultado de la ozonación del bromuro que contenga el agua.
Subproductos del bióxido de cloro
En muchos casos, los productos de la oxidación con bióxido de cloro no contienen átomos de halógeno, y específicamente el bióxido de cloro en presencia de las sustancias húmicas no da lugar a niveles significativos de THMs. No se ha observado la formación de THMs que contienen bromo al tratar materiales húmicos con bióxido de cloro. Tampoco reacciona con el amoníaco para formar cloraminas.
Los productos de la reacción del bióxido de cloro con material orgánico en el agua incluyen clorofenoles, los ácidos maléicos, fumáricos y oxálicos. Un estudio de los subproductos de la reacción del bióxido de cloro en un tratamiento piloto revelo más de 40 SPD, pero su toxicidad es en la mayor parte desconocida (Richarson et al., 1994). La oxidación de los fenoles con bióxido de cloro o con cloro produce compuestos aromáticos clorados intermedios antes de la ruptura de anillos.
Durante la oxidación, el bióxido de cloro se reduce al ión de clorito, el cual en sí mismo es un “carcinógeno” potencial. El ión clorito también puede ser nuevamente oxidado a bióxido de cloro. Ningún valor guía provisional de la OMS ha sido establecido para el bióxido de cloro debido al deterioro rápido a clorito, clorato y cloruro, y porque el valor guía provisional de la OMS establecido para el clorito, 200 µg/L, es un protector adecuado contra la toxicidad potencial del bióxido de cloro.
Subproductos de la cloraminación
El cloruro de cianógeno es un subproducto de la
cloraminación (o cloración en presencia de amoníaco).
Esta sustancia es el resultado de las reacciones de precursores orgánicos
con el ácido hipocloroso en presencia del ión amonio. Típicamente
las concentraciones del cloruro de cianógeno son algo mayores para
la cloraminación que para la cloración. Este compuesto,
dentro del cuerpo humano se metaboliza rápidamente a cianuro que
es tóxico. Por este motivo, la OMS ha establecido un valor guía
provisional de 70 µg/L como cianuro, para los compuestos cianogénicos
totales.
Normas de calidad del agua para los SPD y los desinfectantes
La OMS ha establecido valor guía para dos desinfectantes y quince subproductos potencialmente tóxicos incluyendo los cuatro trihalometanos más comúnmente encontrados en el agua. Para las sustancias identificadas como carcinógenas, los valores de la norma representan la concentración en el agua asociada con un caso adicional de cáncer en 100000 consumidores que ingieren 2 litros de agua diarios por un periodo de setenta años (riesgo de un caso adicional de cáncer = 10-5. La OMS observa, sin embargo, que estos valores no deben considerarse exactos debido a una serie de incertidumbres en los factores utilizados en el modelo matemático desarrollado para determinarlos; en cambio, pueden considerarse como una aproximación del riesgo de cáncer.
La Tabla 3 resume los valores guía de la OMS para tres desinfectantes y la Tabla 4 resume los dieciocho subproductos de la desinfección.

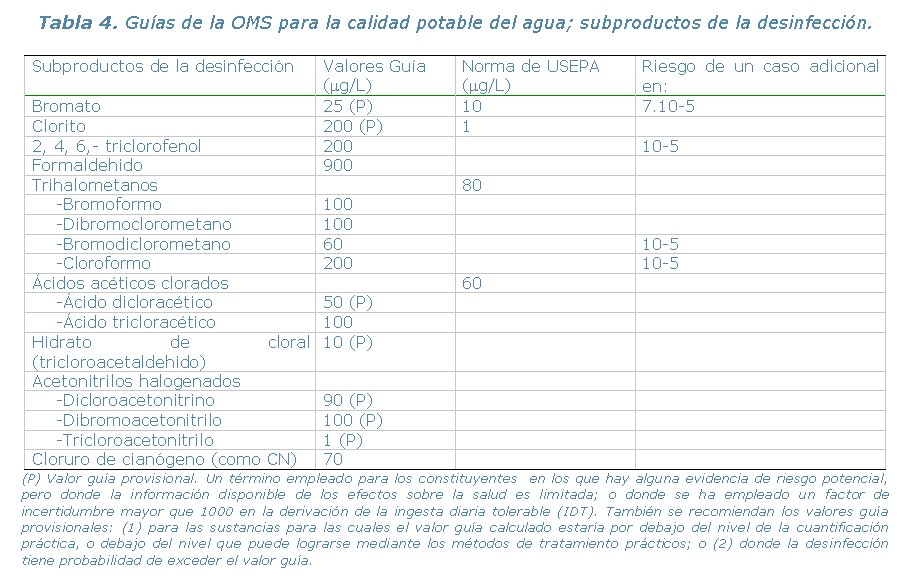
Control de los subproductos de la desinfección
Al seleccionar un desinfectante para que el agua sea microbiológicamente segura, es importante, tanto desde el punto de vista de la salud pública como del costo, estar conscientes sobre los subproductos potenciales de la desinfección y de sus consecuencias para la salud. Para esto será necesario saber qué subproductos se forman bajo qué condiciones, cuáles serían los riesgos para la salud u otros efectos adversos, y cómo éstos pueden reducirse al mínimo. La OMS recomienda que se utilice un enfoque de riesgo – beneficio en el cual se consideren los agentes patógenos, los desinfectantes, los subproductos de la desinfección, la calidad del agua y el costo, para equilibrar las compensaciones entre los riesgos microbianos y los químicos. Como resultado, es por lo tanto crucial que los intentos de controlar los desinfectantes y sus subproductos no comprometan la desinfección misma. La inactivación de los agentes microbianos patógenos con desinfectantes químicos u otros procesos de desinfección equivalentes es esencial para proteger la salud pública.
Los esfuerzos para reducir las concentraciones de SPD deben realizarse sin afectar negativamente la calidad microbiológica del agua. Como los materiales orgánicos halogenados son más difíciles de oxidar y son menos biodegradables, debe evitarse su formación durante las etapas iniciales de los procesos de tratamiento de agua, o al menos reducirlos al mínimo. Si en la etapa inicial se pone énfasis en la remoción de las sustancias orgánicas al máximo grado práctico bajo las condiciones específicas de la planta de tratamiento, se pueden conseguir los siguiente beneficios:
Se reducirá la demanda de cloro
Se reducirán las cantidades de sustancias orgánicas oxidadas que pudieran formarse posteriormente en el proceso
Se reducirán los efectos perjudiciales sobre el agua tratada causados por los niveles de sustancias orgánicas altas y niveles de cloro altos
Se han diseñado varias estrategias para controlar los subproductos de la desinfección. Teniendo en cuenta que la prevención de su formación es más económica y eficaz que la extracción, una vez que se han formado las estrategias principales incluyen:
- La protección y el control de las fuentes de abastecimiento de agua para disminuir o eliminar los precursores
- La reducción de los precursores mediante el mejoramiento del tratamiento antes de la desinfección
- La reducción de la dosificación de cloro y/o el tiempo de contacto al mínimo necesario para la destrucción de agentes patógenos
- La utilización de los desinfectantes alternativos
- La remoción de los subproductos ya formados
La aplicación de estas estrategias debe considerar los efectos de los factores físicos y químicos que influyen la formación de los SPD, la modalidad de reacción de los precursores o los subproductos con los desinfectantes bajo diferentes condiciones, la complejidad técnica del proceso y el costo de las alternativas. Los costos y la complejidad de llevar a cabo algunas de estas estrategias pueden colocarlos fuera del alcance de las comunidades pequeñas de América Latina y el Caribe. Por ejemplo las tecnologías de la membrana adsorción con carbón activado que pueden eliminar los precursores antes de la desinfección son costosas y pueden estar más allá de la capacidad financiera y técnica de estas pequeñas comunidades.
Afortunadamente, el mejoramiento de los procesos existentes, como la coagulación, la floculación y la sedimentación pueden hacer más eficaz la remoción de la materia orgánica natural. Numerosos estudios han revelado la eficacia del alumbre así como de las sales férricas para conseguir este objetivo. La operación y el control más cuidadosos de la floculación, sedimentación y de los procesos de filtración a menudo pueden mejorar la remoción de precursores y simultáneamente reducir el uso de las sustancias químicas para la desinfección. Una de las soluciones más sencillas para la reducción de la formación de THMs es el mover el primer punto de la aplicación de cloro al final en el proceso de tratamiento (eliminar la precloración).
Riesgos relativos para la salud
Las principales preocupaciones que existen sobre los SPDs
incluye: 1. Daño en las funciones reproductoras, es decir, disminución
en la fertilidad, mal parto; 2. Lesión en el desarrollo fetal dentro
del útero e inmediatamente después del parto y; 3. Desarrollo
de cáncer. Durante la última década se llevaron a
cabo numerosos estudios para evaluar la toxicidad de los SPDs. Estos estudios
incluyeron tanto sujetos humanos como animales. En 1998 la noción
percibida era que la exposición al agua clorada no podía
ser definitivamente ligada a efectos adversos en la reproducción
o el desarrollo, a los niveles determinados para agua tratada. Las agencias
de salud estadounidenses, incluyendo a la Sociedad Americana para Microbiología
(ASM), y la Agencia de Protección del Medio Ambiente de los EEUU
(USEPA), apoyaron esta conclusión. Estudios más recientes
han mostrado asociaciones moderadas entre los SPDs y un peso bajo de nacimiento,
defectos del tubo neural y abortos espontáneos.
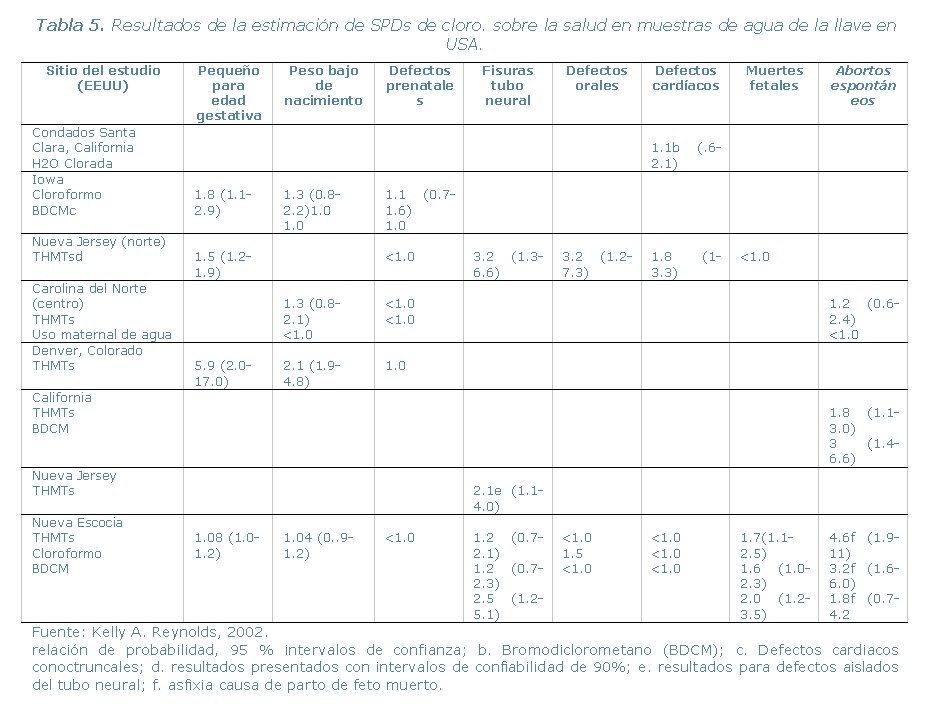
En la Tabla 5, se muestra los resultados de la estimación
de SPDs de cloro sobre la salud en muestras de agua de la llave en USA.
Una tasa de probabilidad mayor que 1, indica un aumento multiplicativo
en el riesgo del resultado específico. En cuatro estudios ilustrados
en esta Tabla (Iowa, norte de Nueva Jersey, Denver y Nueva Escocia),
se mostró una leve asociación entre los SPDs y un bajo peso
de nacimiento (pequeño para la edad gestativa, SGA), mientras dos
de los estudios (Nueva Jersey y Nueva Escocia) indicaron una asociación
con los defectos del tubo neural y defectos de fisuras. Dos estudios (Norte
de Nueva Jersey y Nueva Jersey) estuvieron en conflicto con respecto a
una asociación con efectos cardiacos, mientras que otro mostró
una asociación con el aborto espontáneo (California). Con
respecto a la muerte fetal, no pudo hacerse ninguna corelación
consistente (Nueva Jersey y Nueva Escocia).
Se espera que la continuación de los estudios defina
de manera más definitiva los niveles de exposición y los
resultados asociados con la salud a SPDs. Además, aún existen
preguntas con respecto a los efectos tóxicos de la exposición
a múltiples SPDs a través del tiempo. Mientras continúa
la investigación, las agencias de salud están tomando un
enfoque proactivo sugiriendo niveles seguros de ingestión para
varios SPDs, por ejemplo, la USEPA recientemente redujo el Nivel Máximo
Contaminante de los trihalometanos totales de 100 µg/L a 80 µg/L. Los
niveles recomendados por la OMS aparecen en la Tabla 6.

Los oficiales de salud pública advierten que los riesgos a la salud
de los THMs son pequeños comparados con los riesgos asociados con
las enfermedades propagadas a través del agua. De tal manera que
es importante continuar con el proceso de desinfección, a menos
que éste pueda ser sustituido por una alternativa efectiva para
asegurar un suministro de agua más seguro. Tomemos en cuenta la
situación en Perú en 1991, donde los procesos de cloración
fueron detenidos en parte debido a la preocupación con respecto
a los efectos potenciales a la salud de los THMs. El resultado de esto
fue el primer brote de cólera en Latinoamérica ocasionó
más de 1 millón de casos y 13,000 muertes. En los países
desarrollados, el agua que contiene más de 80 µg/L de THMs es
considerada inaceptable para consumo. Sin embargo, los suministros alternos
pueden no estar accesibles.
Conclusiones
Es necesario llevar a cabo estudios adicionales para especificar los riesgos a la salud humana que presentan los trihalometanos y otros productos relacionados con la desinfección del cloro. Sin embargo, se ha demostrado que la desinfección de fuentes de agua potable principalmente utilizando cloro, fue el factor principal para reducir el número de muertes y enfermedades en los seres humanos a causa de patógenos propagados a través del agua, durante el siglo XX. Hoy en día, se encuentran disponibles más que nunca, métodos de tratamiento con los cuales, tanto los SPDs como sus precursores orgánicos, pueden ser eliminados del agua.
Bibliografía
BOVE, F, 2002. TTHMS, TCE AND PCE. Drinking Water Contaminants
and Adverse Preegnancy Outcomes. Agency for Toxic Substances and Disease
Registry (ATSDR), CDC, Atlanta, EE.UU., WC&P, pp. 42-47.
CENTER FOR DISEASE CONTROL AND PREVENTION (CDC). 1999. Achievements in
Public Health, 1900-1999: Control of Infectious Diseases. CDC, Atlanta,
EE.UU., Morbility and Mortality Weekly Report, 30 de Julio, 1999.
ENVIRONMENTAL PROTECTION AGENCY (USEPA), 1998. National Primary Drinking
Water Regulations: Disinfectants and Disinfection Byproducts; Final Rule,
USEPA, Federal Register, 63 (241): 69389-69476, 40 CFR, 16 de diciembre,
1998.
ETTINGER, M. B. AND RUCHHOFT, C. C. 1951. Effects of stepwise chlorination
on taste and odor producing intensity of some phenolic compounds. J. AWWA.
Julio 1991.
IARC. 1991 Chlorinated Drinking Water; Chlorination by-products; Some
others Halogenated Compounds. Monographs on the Evaluation of Carcinogenic
Risks to Humans. Vol 52. IARC, Lyon, Francia.
KELLY A. REYNOLDS. 2002. Desinfección con cloro y riesgos de los
productos derivados de la desinfección. Agua Latinoamericana. Julio/Agosto:46-48
RICHARSON, S. D. THURSTON A.D. AND COLLETTE T. W. 1994. Multispectral
identification of chlorine dioxide disinfection by products in drinking
water. Environmental Science and Technology, 28:1526-1536.
ROOK, J. J. 1974. Formation of haloforms during chlorination of natural
waters. J. Wtr. Trmt. Exam. 23:234-243.
WORTH HEALTH ORGANIZATION (OMS). 1985. Guidelines for drinking water quality.
Vol. 2. Health Criteria and Other Supporting Information, Ginebra, Suiza.