La molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno unidos por enlace covalente polar, esta polaridad hace que presente unas propiedades distintas a compuestos químicos de la misma familia de la tabla periódica. De este modo origina la formación de puentes de hidrógeno, enlaces entre un átomo de hidrógeno de una molécula y un átomo de oxígeno de otra, lo que conlleva que:
- El agua se presente en los tres estados de la materia en la superficie terrestre (puesto que su temperatura de ebullición es de 100º C a 1 atm de presión y la de congelación es de 0º C)
- El agua se expanda al solidificar, de tal modo que es menos densa que el agua líquida y flota sobre ésta conservando la vida subacuática en climas fríos.
- El agua presente un elevado calor específico (energía necesaria para aumentar la temperatura de un gramo de una sustancia en 1º C) de modo que puede absorber o liberar gran cantidad de calor sin que su temperatura varíe de forma importante. Esta propiedad hace que las grandes masas de agua puedan funcionar como acumuladores de calor solar, moderando los climas costeros y que las corrientes oceánicas puedan transferir cantidades notables de energía en forma de calor de unas zonas a otras. También posibilita que los seres vivos, a pesar de que desprenden calor al medio, puedan mantener una temperatura compatible con la tolerancia térmica de los constituyentes orgánicos primordiales (por ejemplo, las proteínas)
- El agua presente una tensión superficial (medida de la resistencia que ofrecen los líquidos a la rotura de la superficie) relativamente alta, lo que, permite la flotación de los organismos y permite la circulación de soluciones acuosas (savia) en las plantas si tenemos en cuenta la adhesión del agua.
- La constante dieléctrica del agua sobrepase a la de prácticamente cualquier otro líquido ordinario, lo cual le confiere una extraordinaria capacidad disolvente para todo tipo de sustancias polares, ácidas, bases y sales con las que pueda entrar en contacto. Esto es una propiedad de gran importancia tanto en los procesos geológicos superficiales como los biológicos, pero también la hace muy susceptible a la contaminación.
- El agua permita, debido a su estructura microscópica, la penetración de la luz en las aguas, fenómeno de gran importancia para los organismos acuáticos ya que posibilita la fotosíntesis y en consecuencia la disolución de oxígeno en el agua y el aporte de nutrientes.
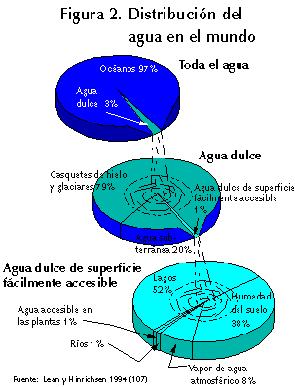
El agua es además un elemento vital que sostiene ecosistemas y actividad humana (compone el 75% de nuestro cuerpo y cubre aproximadamente el 71 % del planeta) Se trata por tanto, del compuesto químico más abundante de la biosfera. Ocupa una zona comprendida entre la isoterma de 1200ºC en el interior de la tierra y la tropopausa de la atmósfera. En estado líquido rellena las grandes depresiones a escala cortical, constituyendo los mares y océanos, también pequeñas depresiones del terreno, constituyendo cauces y lagos, al mismo tiempo que rellena poros y fisuras del terreno. En estado sólido forma glaciares y banquisas y en estado gaseoso se encuentra en la atmósfera formando la llamada agua atmosférica.
Cerca del 96.5% del agua del planeta se encuentra en los océanos y mares, el agua dulce restante se encuentra mayoritariamente en los hielos polares y en las profundidades del terreno como agua subterránea. Solamente el 0.1% del agua terrestre se encuentra en forma de aguas superficiales y atmosféricas. Este porcentaje hace que, pese a su abundancia, el agua sea un recurso escaso y por tanto muy preciado.