Ozono
El ozono (O3) es un estado alotrópico del oxígeno en el que su molécula, que es la forma estable de presentarse en la naturaleza, se compone de tres átomos.
La radiación ultravioleta rompe con gran facilidad la molécula de oxígeno (O2) cuando un fotón incide sobre ella dejando libres dos átomos, que al ser inestables tienen un poder altamente reactivo. Así, al no poder permanecer en solitario, los átomos de oxígeno tienden a combinarse inmediatamente con las moléculas de su mismo elemento, muy abundante en la estratosfera. El resultado es una molécula de ozono (O+O2 = O3).
Pero a la vez que se crean moléculas de ozono, los rayos ultravioleta siguen destruyendo otras, rompiendo los enlaces entre los tres átomos y formando, por cada dos moléculas de ozono, tres de oxígeno.
En el supuesto de que no intervengan otras causas, el resultado debería ser que la concentración de ozono alcance un régimen estacionario dinámico, en el cual el grado de formación sea igual al de destrucción. Este mecanismo autorregulado ha permanecido inalterado en el curso de millones de años defendiéndonos de la agresión de la luz ultravioleta.
Sin embargo esta generación y destrucción constante de ozono se ha visto alterada en las últimas décadas por diversas sustancias emitidas por las actividades humanas, principalmente por la emisión de distintos gases, como los CFC's (clorofluorocarbonos), los HCFC's y otros refrigerantes y propelentes a base de propano, butano y pentano, los halones, utilizados en extintores de incendios y el metil bromuro, un pesticida de amplio espectro.
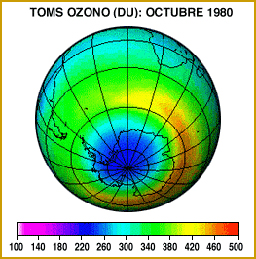
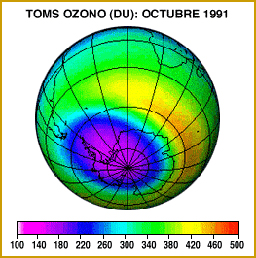
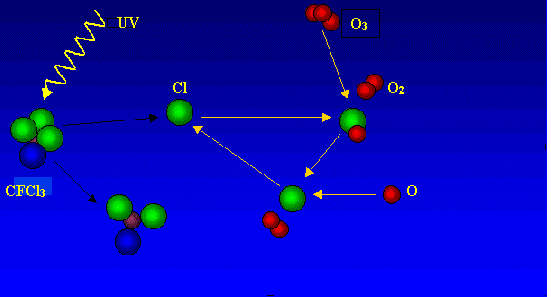
Al alcanzar los CFC las zonas más altas de la atmósfera, por encima de los 20 kilómetros, donde la concentración de ozono es máxima, se inicia la reacción. Los átomos de cloro (Cl), que es el elemento más reactivo de los CFC, arrebata al ozono uno de sus átomos. Como resultado se forma una nueva molécula de monóxido de cloro (ClO) y otra de oxígeno. Esta última ya no es capaz de detener los rayos ultravioleta, que llegan finalmente hasta la superficie de la Tierra. El átomo de oxígeno del monóxido de cloro, a su vez, captura un átomo libre de oxígeno procedente de la ruptura de una molécula del mismo elemento (O2) por la radiación ultravioleta. En esta reacción se vuelve a formar una nueva molécula de oxígeno, quedando libre el átomo de cloro, el cual iniciará nuevamente el ciclo de reacción con el ozono.
Las posibles consecuencias de la reducción del ozono estratosférico
se relacionan con el aumento de la radiación solar ultravioleta-B,
que pueden incidir sobre la salud humana ocasionando un incremento de
los cánceres de piel, de enfermedades oculares como las cataratas
y la inhibición del sistema inmunológico por exceso de radiación.
También incide con una disminución de las cosechas al retrasar
el crecimiento de las plantas, así como la masa total de fitoplancton
y krill de los océanos, bases de la alimentación de muchas
especies marinas y de la cadena alimenticia. De igual manera el aumento
de la radiación solar tendría efectos sobre el cambio climático.